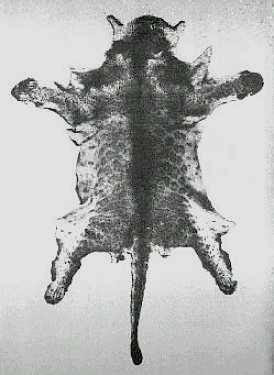
El tamaraw, conocido en español como búfalo de Mindoro o tamarao (Bubalus mindorensis, Heude, 1888), es un búfalo endémico de la isla filipina del mismo nombre. Se trata del mamífero terrestre de mayor tamaño nativo de las Filipinas, además de ser uno de los animales más escasos y menos conocidos del mundo. Su aspecto recuerda al del búfalo asiático de agua (Bubalus arnee) en muchos aspectos, excepto en el tamaño, mucho más reducido. De hecho, los análisis de ADN muestran una relación muy estrecha entre ambas especies, tanto que el tamaraw llegó a ser considerado una subespecie del búfalo de agua por algunos autores. Asimismo, muestra gran parecido con el anoa de montaña (Bubalus quarlesi) y el anoa de tierras bajas (Bubalus depressicornis), dos bóvidos nativos de Indonesia y considerados miniaturas del búfalo de agua. Tampoco debe ser confundido con el carabao (Bubalus bubalis carabanesis), una forma doméstica del búfalo de agua criada en las Filipinas.
Su pequeño tamaño y sus cuernos rectos son las dos principales características que llevaron a los expertos a dar al tamaraw la categoría de especie, diferenciándolo así de su pariente el búfalo asiático de agua. Llega a alcanzar poco más de 1 metro de altura. La longitud de la cabeza y el cuerpo es de aproximadamente 220 centímetros, a los que hay que sumar 60 centímetros de cola. El peso ha sido medido sólo para las hembras, oscilando entre 180 y 300 kilogramos. La forma de los cuernos puede ser usada para distinguir los sexos. Los cuernos de los machos son más gruesos, más largos, más planos y más cercanos entre sí que los de las hembras. Además, también pueden usarse para determinar la edad de los individuos, ya que crecen a mayor ritmo que las orejas y se van separando en la base a medida que el animal madura. Tanto en machos como en hembras los cuernos crecen en "V", en contraposición a la forma de "C" en arco de los cuernos del búfalo de agua.
El pelaje del adulto es de color marrón oscuro o negro grisáceo. Pueden diferenciarse por el color los juveniles, cuyo pelaje es pardo-rojizo, con las patas de color marrón oscuro y una línea dorsal negra. Esta coloración cambia a una especie de color pizarra entre los 3 y los 4 años de edad, alcanzándose la coloración adulta a los 5 años. En la mayoría de individuos el pelaje color pizarra se oscurece, tan sólo algunas hembras adultas son más bien de color marrón. Unas marcas blancas están presentes encima de las pezuñas y en el interior de la parte baja de las extremidades anteriores. Asimismo, la mayoría de individuos presentan unas líneas de color blanco-grisáceo que van desde la esquina interior de los ojos hacia los cuernos. Algunos ejemplares pueden tener marcas blanquecinas en ambos lados de la mandíbula inferior. También puede existir una mancha blanca en la garganta.
El dimorfismo sexual es poco evidente en esta especie. Los caracteres que permiten distinguir entre machos y hembras son muy escasos, reduciéndose a las pequeñas diferencias en los cuernos, el pelaje marrón oscuro de algunas hembras adultas o el cuello más grueso en los machos que en las hembras.
La isla de Mindoro ocupa un área de 9.735 kilómetros cuadrados. Antiguamente, el tamaraw estaba ampliamente extendido por su territorio, pero hoy en día se encuentra únicamente en el interior montañoso de la isla, ocupando un territorio de entre 100 y 300 kilómetros cuadrados en el Parque Nacional Mount Iglit-Baco -el área protegida más grande de Mindoro, en el centro de la isla-, el Monte Aruyan -en el Municipio de Sablayan- y en el Santuario de Vida Natural del Monte Calavite -en el extremo norte de la isla-. Por tanto la especie se distribuye en tres subpoblaciones que habitan la Provincia de Mindoro Occidental. Se sospecha además que existen unos pocos grupos aislados de animales fuera de estas tres subpoblaciones. En tiempos prehistóricos el tamaraw se distribuía por otras islas de Filipinas, existiendo registros en la isla de Luzón que datan del Pleistoceno.
Área de distribución del búfalo de Mindoro
La especie se encuentra "En Peligro Crítico de Extinción" según la UICN (Unión Internacional para la Conservación de la Naturaleza), debido al hecho de que en la actualidad existen menos de 250 individuos maduros y se estima que la población siga en retroceso durante sus tres próximas generaciones. Además, se cree que más del 90% del total de estos animales se encuentran en la subpoblación del Parque Nacional Mount Iglit-Baco. Las otras dos subpoblaciones albergan cada una alrededor de tan solo 20 animales.
En 1900, la población total de tamaraw se estimaba en unos 10.000 animales. En 1987 se estima que quedaban tan sólo unos 370, mientras la población total a día de hoy se sospecha que está en torno a 300 individuos -alrededor de 400 según las estimaciones más optimistas-.
Antiguamente podía encontrarse al tamaraw desde el nivel del mar hasta altitudes superiores a 1.800 metros, habitando pastizales, claros del bosque, selvas de bambú, valles pantanosos y bosques de baja a media elevación. Actualmente la especie se encuentra confinada en áreas muy reducidas, por encima de los 200 metros de altitud. Es más frecuente encontrarlo en bosques secundarios y en mosaicos de bosque / pastizal. Los bosques de dipterocarpaceas originales de la región se encuentran sólo como restos a lo largo de las crestas calizas, donde están protegidos del fuego. La alimentación de estos animales se compone de varias especies de herbáceas y brotes tiernos de bambú.
El tamaraw ha pasado de ser un animal diurno a ser principalmente nocturno, debido a la invasión de su territorio por parte de los humanos y las consecuentes molestias generadas a la especie. Tiene por costumbre descansar entre hierbas altas o en la profundidad del bosque. Al igual que otros búfalos, le gusta revolcarse en el fango, más durante el día que durante la noche y principalmente durante la estación lluviosa.
Es un animal más solitario que otros bóvidos, especialmente los machos adultos, los cuales nunca se asocian entre ellos, tan solo con hembras durante un breve tiempo en el periodo reproductor. Se ha sugerido que esta naturaleza solitaria puede suponer una adaptación al medio boscoso, donde los grandes grupos pueden suponer un problema. Hipótesis que es reforzada por el hecho de que en determinadas zonas del Parque Nacional Mount Iglit-Baco, el tamaraw puede ser visto formando grandes grupos, debido a la relativa protección que les ofrece el entorno. Además, muestran más actividad diurna en estas zonas.
El periodo de gestación dura de 276 a 315 días, después de los cuales, nace un solo ternero. No está del todo aclarado la época en la que estos animales dan a luz. El periodo óptimo para ello sería durante la estación lluviosa de Mindoro -de Junio a Noviembre-, cuando más abunda su alimento. Sin embargo, en la zona del Monte Iglit, los informes sobre recién nacidos y animales jóvenes se restringían a los meses de Diciembre y Enero durante las observaciones realizadas en 1966. Los animales jóvenes permanecen con sus madres bastante tiempo, hasta los 2-4 años de edad. El intervalo entre parto y parto es de 2 años. La longevidad del tamaraw en la naturaleza se estima entre 20 y 25 años.
Durante el siglo XX la principal amenaza para el tamaraw fue la pérdida de territorio debido a las prácticas ganaderas y agrícolas de los seres humanos. Una amenaza derivada de la ganadería es la posible transmisión de enfermedades infecciosas a estos animales desde el ganado doméstico. Históricamente el tamaraw fue cazado tanto como trofeo de caza como para consumo de los habitantes locales, contribuyendo estas actividades a un declive importante de su población. Desde la Segunda Guerra Mundial, el incremento de la población humana, la tala de bosques, la ganadería y la extensión del uso de armas de fuego en la isla de Mindoro, han tenido un gran impacto en el número de estos animales. A partir de los años 80, la caza deportiva se ha reducido mucho debido al declive de su población y a una vigilancia y concienciación más intensas después de la creación de las zonas protegidas en su área de distribución. Actualmente, la principal amenaza para el búfalo de Mindoro es la falta de opciones que tienen estos animales a la hora de dispersarse y extender su rango de distribución, debido a la presión de las poblaciones humanas. La caza tradicional por parte de los indígenas locales supone un problema, incluso si el tamaraw no es un objetivo, ya que pueden caer presa de trampas dirigidas a otras especies. También la caza furtiva sigue amenazando hoy en día a esta especie.
El tamaraw está listado en el Apéndice I de CITES (Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres). La especie recibe protección total por parte del gobierno filipino. A pesar de ello, el programa para su cría en cautividad no ha tenido éxito. De los veintiún individuos capturados a principios de los años 80, tan sólo quedaban nueve en 1997. En 2015, un único ejemplar sobrevivía en cautividad. Una mala gestión del recinto que albergaba a estos animales ha sido la principal causa del fracaso de este programa. Es necesario realizar estudios adicionales para determinar si existen animales fuera de los tres núcleos de población conocidos.
Más información sobre el búfalo de Mindoro:
http://www.feu.edu.ph/manila/index.php/support-a-cause/tamaraw-times-two-by-2020/save-the-tamaraw/
https://www.youtube.com/watch?v=NHt3mS_ELGk
http://animaldiversity.org/accounts/Bubalus_mindorensis/
http://www.wildcattleconservation.org/SpeciesFactSheets/bubalus-mindorensis.htm
http://www.ultimateungulate.com/artiodactyla/bubalus_mindorensisfull.html
http://www.iucnredlist.org/details/full/3127/0
https://www.youtube.com/watch?v=AYWdnp1rKaU
https://www.youtube.com/watch?v=U9VIOMFt3rk
https://es.wikipedia.org/wiki/Bubalus_mindorensis
http://www.arkive.org/tamaraw/bubalus-mindorensis/
 |
| Macho adulto de tamaraw en el Parque Nacional Mount Iglit-Baco, en la provincia de Mindoro Occidental (Filipinas). Fotografía de Gregg Yan (2012). Wikimedia Commons. |
Su pequeño tamaño y sus cuernos rectos son las dos principales características que llevaron a los expertos a dar al tamaraw la categoría de especie, diferenciándolo así de su pariente el búfalo asiático de agua. Llega a alcanzar poco más de 1 metro de altura. La longitud de la cabeza y el cuerpo es de aproximadamente 220 centímetros, a los que hay que sumar 60 centímetros de cola. El peso ha sido medido sólo para las hembras, oscilando entre 180 y 300 kilogramos. La forma de los cuernos puede ser usada para distinguir los sexos. Los cuernos de los machos son más gruesos, más largos, más planos y más cercanos entre sí que los de las hembras. Además, también pueden usarse para determinar la edad de los individuos, ya que crecen a mayor ritmo que las orejas y se van separando en la base a medida que el animal madura. Tanto en machos como en hembras los cuernos crecen en "V", en contraposición a la forma de "C" en arco de los cuernos del búfalo de agua.
El pelaje del adulto es de color marrón oscuro o negro grisáceo. Pueden diferenciarse por el color los juveniles, cuyo pelaje es pardo-rojizo, con las patas de color marrón oscuro y una línea dorsal negra. Esta coloración cambia a una especie de color pizarra entre los 3 y los 4 años de edad, alcanzándose la coloración adulta a los 5 años. En la mayoría de individuos el pelaje color pizarra se oscurece, tan sólo algunas hembras adultas son más bien de color marrón. Unas marcas blancas están presentes encima de las pezuñas y en el interior de la parte baja de las extremidades anteriores. Asimismo, la mayoría de individuos presentan unas líneas de color blanco-grisáceo que van desde la esquina interior de los ojos hacia los cuernos. Algunos ejemplares pueden tener marcas blanquecinas en ambos lados de la mandíbula inferior. También puede existir una mancha blanca en la garganta.
El dimorfismo sexual es poco evidente en esta especie. Los caracteres que permiten distinguir entre machos y hembras son muy escasos, reduciéndose a las pequeñas diferencias en los cuernos, el pelaje marrón oscuro de algunas hembras adultas o el cuello más grueso en los machos que en las hembras.
 |
| Búfalo de Mindoro pastando en el Parque Nacional Mount Iglit-Baco. Fotografía de Gregg Yan (fuente). |
La isla de Mindoro ocupa un área de 9.735 kilómetros cuadrados. Antiguamente, el tamaraw estaba ampliamente extendido por su territorio, pero hoy en día se encuentra únicamente en el interior montañoso de la isla, ocupando un territorio de entre 100 y 300 kilómetros cuadrados en el Parque Nacional Mount Iglit-Baco -el área protegida más grande de Mindoro, en el centro de la isla-, el Monte Aruyan -en el Municipio de Sablayan- y en el Santuario de Vida Natural del Monte Calavite -en el extremo norte de la isla-. Por tanto la especie se distribuye en tres subpoblaciones que habitan la Provincia de Mindoro Occidental. Se sospecha además que existen unos pocos grupos aislados de animales fuera de estas tres subpoblaciones. En tiempos prehistóricos el tamaraw se distribuía por otras islas de Filipinas, existiendo registros en la isla de Luzón que datan del Pleistoceno.
Área de distribución del búfalo de Mindoro
La especie se encuentra "En Peligro Crítico de Extinción" según la UICN (Unión Internacional para la Conservación de la Naturaleza), debido al hecho de que en la actualidad existen menos de 250 individuos maduros y se estima que la población siga en retroceso durante sus tres próximas generaciones. Además, se cree que más del 90% del total de estos animales se encuentran en la subpoblación del Parque Nacional Mount Iglit-Baco. Las otras dos subpoblaciones albergan cada una alrededor de tan solo 20 animales.
En 1900, la población total de tamaraw se estimaba en unos 10.000 animales. En 1987 se estima que quedaban tan sólo unos 370, mientras la población total a día de hoy se sospecha que está en torno a 300 individuos -alrededor de 400 según las estimaciones más optimistas-.
 |
| Sello postal de Filipinas haciendo referencia al programa "Salvar al tamaraw" de la Far Eastern University de Manila, que pretende doblar el número de ejemplares de la especie para 2020 (fuente) |
El tamaraw ha pasado de ser un animal diurno a ser principalmente nocturno, debido a la invasión de su territorio por parte de los humanos y las consecuentes molestias generadas a la especie. Tiene por costumbre descansar entre hierbas altas o en la profundidad del bosque. Al igual que otros búfalos, le gusta revolcarse en el fango, más durante el día que durante la noche y principalmente durante la estación lluviosa.
Es un animal más solitario que otros bóvidos, especialmente los machos adultos, los cuales nunca se asocian entre ellos, tan solo con hembras durante un breve tiempo en el periodo reproductor. Se ha sugerido que esta naturaleza solitaria puede suponer una adaptación al medio boscoso, donde los grandes grupos pueden suponer un problema. Hipótesis que es reforzada por el hecho de que en determinadas zonas del Parque Nacional Mount Iglit-Baco, el tamaraw puede ser visto formando grandes grupos, debido a la relativa protección que les ofrece el entorno. Además, muestran más actividad diurna en estas zonas.
El periodo de gestación dura de 276 a 315 días, después de los cuales, nace un solo ternero. No está del todo aclarado la época en la que estos animales dan a luz. El periodo óptimo para ello sería durante la estación lluviosa de Mindoro -de Junio a Noviembre-, cuando más abunda su alimento. Sin embargo, en la zona del Monte Iglit, los informes sobre recién nacidos y animales jóvenes se restringían a los meses de Diciembre y Enero durante las observaciones realizadas en 1966. Los animales jóvenes permanecen con sus madres bastante tiempo, hasta los 2-4 años de edad. El intervalo entre parto y parto es de 2 años. La longevidad del tamaraw en la naturaleza se estima entre 20 y 25 años.
Durante el siglo XX la principal amenaza para el tamaraw fue la pérdida de territorio debido a las prácticas ganaderas y agrícolas de los seres humanos. Una amenaza derivada de la ganadería es la posible transmisión de enfermedades infecciosas a estos animales desde el ganado doméstico. Históricamente el tamaraw fue cazado tanto como trofeo de caza como para consumo de los habitantes locales, contribuyendo estas actividades a un declive importante de su población. Desde la Segunda Guerra Mundial, el incremento de la población humana, la tala de bosques, la ganadería y la extensión del uso de armas de fuego en la isla de Mindoro, han tenido un gran impacto en el número de estos animales. A partir de los años 80, la caza deportiva se ha reducido mucho debido al declive de su población y a una vigilancia y concienciación más intensas después de la creación de las zonas protegidas en su área de distribución. Actualmente, la principal amenaza para el búfalo de Mindoro es la falta de opciones que tienen estos animales a la hora de dispersarse y extender su rango de distribución, debido a la presión de las poblaciones humanas. La caza tradicional por parte de los indígenas locales supone un problema, incluso si el tamaraw no es un objetivo, ya que pueden caer presa de trampas dirigidas a otras especies. También la caza furtiva sigue amenazando hoy en día a esta especie.
El tamaraw está listado en el Apéndice I de CITES (Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres). La especie recibe protección total por parte del gobierno filipino. A pesar de ello, el programa para su cría en cautividad no ha tenido éxito. De los veintiún individuos capturados a principios de los años 80, tan sólo quedaban nueve en 1997. En 2015, un único ejemplar sobrevivía en cautividad. Una mala gestión del recinto que albergaba a estos animales ha sido la principal causa del fracaso de este programa. Es necesario realizar estudios adicionales para determinar si existen animales fuera de los tres núcleos de población conocidos.
Más información sobre el búfalo de Mindoro:
http://www.feu.edu.ph/manila/index.php/support-a-cause/tamaraw-times-two-by-2020/save-the-tamaraw/
https://www.youtube.com/watch?v=NHt3mS_ELGk
http://animaldiversity.org/accounts/Bubalus_mindorensis/
http://www.wildcattleconservation.org/SpeciesFactSheets/bubalus-mindorensis.htm
http://www.ultimateungulate.com/artiodactyla/bubalus_mindorensisfull.html
http://www.iucnredlist.org/details/full/3127/0
https://www.youtube.com/watch?v=AYWdnp1rKaU
https://www.youtube.com/watch?v=U9VIOMFt3rk
https://es.wikipedia.org/wiki/Bubalus_mindorensis
http://www.arkive.org/tamaraw/bubalus-mindorensis/